V posledních letech jsme se na poli veterinární léčby rakoviny dočkali mnoha pokroků, reprezentujících první průniky do nových oblastí medicíny. Výsledné farmaceutické látky či strategie jsou průkopnickými terapiemi, které vyvolávají zájem nejen díky tomu, že představují nové přístupy k léčbě rakoviny, ale i proto, že přinesly skutečné důkazy pokroku v kontrole nemocí.
Tento článek má za cíl představit tři nové antineoplastické léčebné strategie, nastínit rozdíly mezi starými a novými přístupy a ve vhodných případech poskytnout klinické poradenství.
Zabývat se budeme těmito léčebnými paradigmaty:
- Metronomická chemoterapie
- Inhibitory tyrosinkinázy
- Liposomální nanočástice
Hlavním mechanismem účinku metronomické chemoterapie je antiproliferativní efekt, zaměřený na prekurzory endotelových buněk krevních cév aktivovaných nádorů. Druhým mechanismem působení je zvýšení produkce a uvolňování endogenních inhibitorů angiogeneze, nicméně v současnosti se metronomická chemoterapie stále nachází v zóně aktivního výzkumu. Rovněž je důležité zmínit, že zatím neexistují léky schválené pro podávání psům nebo kočkám.
Mezi více využívané pak patří inhibitory proteinových kináz, které blokují specifickou kinázu a tedy přenos signálu na další molekulu. K léčbě se mohou využít inhibitory, které blokují prorůstové signály nebo signály bránící apoptóze. Blokáda může být cílena na nádorovou buňku nebo na angiogenezi.
Lipozomální nanočástice lze použít k solubilizaci široké škály léčivých látek pro zlepšení jejich farmakologických vlastností.
Více podrobností v článku.
NOVÉ LÉČEBNÉ PŘÍSTUPY VE VETERINÁRNÍ LÉČBĚ RAKOVINY
Tento článek má za cíl představit tři nové antineoplastické léčebné strategie, nastínit rozdíly mezi starými a novými přístupy a ve vhodných případech poskytnout klinické poradenství.
Gerry Polton, klinický onkolog odborného pracoviště North Downs, Surrey, UK
Přeložil MVDr. Radek Kašpar
I. METRONOMICKÁ CHEMOTERAPIE
Koncepce metronomické či tzv. „nízkodávkové“ chemoterapie je založena na pozorování, že některé konvenční cytotoxické látky mohou při podávání v nízkých dávkách projevovat antiangiogenní účinky. Tento efekt byl poprvé prokázán v roce 2000 (Browder 2000), počátky výzkumu vedoucího k tomuto objevu však lze vystopovat až do roku 1971, kdy Judah Folkman popsal zásadní význam proangiogenního fenotypu pro rozvoj rakoviny (Folkman 1971).
Existuje celá řada popsaných mechanismů účinku metronomické chemoterapie. Prvním z nich je antiproliferativní efekt, zaměřený na prekurzory endotelových buněk krevních cév aktivovaných nádorů. Tyto buňky se uvolňují z kostní dřeně a pod vlivem chemického řízení vznikajícího nádoru putují do míst, kde nádor vzniká. Prekurzorové buňky endotelu nejsou samy o sobě neoplastické, stávají se však významnými strukturními prvky, které růst neoplastických buněk umožňují, a to jak v místě primárního nádoru, tak v oblastech metastáz. Předpokládá se, že metronomická chemoterapie má na proliferaci těchto buněk přímý chemický účinek. Průběžné podávání nízkých dávek umožňuje nepřetržitou kontrolu těchto buněk (na rozdíl od konvenčního dávkování chemoterapie, které jim obvykle dopřává období rychlého růstu). Rezistence vůči lékům, se kterou se můžeme setkat u neoplastických buněk pravděpodobně nemá vliv na senzitivitu prekurzorů endotelových buněk na metronomickou chemoterapii (Browder 2000).
Druhým mechanismem působení je zvýšení produkce a uvolňování endogenních inhibitorů angiogeneze (Ng, 2004). Angiogeneze se popisuje jako rovnovážný proces. Za normálních podmínek (homeostáze) jsou proangiogenní a antiangiogenní faktory produkovány ve stejném množství a je zachováván stav vaskulární dormance. Pro úspěšný rozvoj rakoviny musí nicméně dojít k angiogennímu přepnutí (switch), které vede k přebytku proangiogenních faktorů a růstu nových cév. Endogenních antiangiogenních faktorů již byla identifikována celá řada. Zejména u jednoho z nich, trombospondinu-1, byla zjištěna schopnost indukovat apoptózu endotelových buněk. V důsledku podávání nízkých dávek cyklofosfamidu je trompospondin-1 navyšován (up-regulován) a nastává apoptóza endotelových buněk a suprese růstu nádoru (Hamano 2004).
Mezi další navrhované mechanismy působení patří normalizace protinádorové imunity a navození dormance nádoru (Pasquier 2010, Burton 2011).
Momentálně probíhající výzkum se zaměřuje na poznání skutečných mechanismů působení metronomické chemoterapie, což umožní pokročit v inteligentním designu vylepšených léčiv a léčebných harmonogramů.
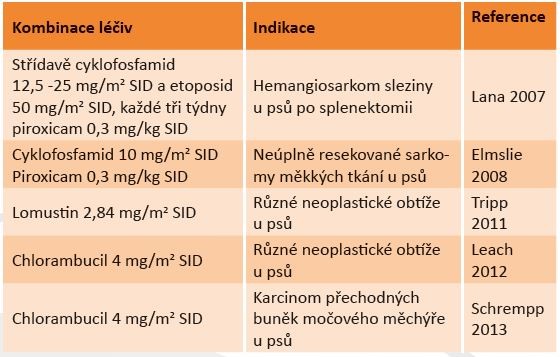
Většina publikovaných prací na téma metronomické chemoterapie uvádí výzkum na laboratorních hlodavcích a nádorových xenoštěpech. V oblasti veterinární medicíny existuje pět publikovaných studií, uvádějících výsledky použití metronomické chemoterapie na skupinách psů. První dvě práce se zabývají metronomickou chemoterapií následující po splenektomii u hemangiosarkomu sleziny (Lana, 2007) a po resekci sarkomu měkké tkáně u psů (Elmslie 2008). Existují také dvě práce dokumentující použití metronomické chemoterapie u skupiny psů s různorodými nádorovými projevy. Jedna z nich uvádí použití každodenních dávek lomustinu (Tripp 2011), druhá každodenních dávek chlorambucilu (Leach 2012). Žádná z těchto prací nepřináší přesvědčivé důkazy o vyšší účinnosti metronomické chemoterapie oproti tomu, co lze označit jako standardní péči. Jisté důkazy o její účinnosti však přinášejí. U psů s hemangiosarkomem bylo přežití léčených případů srovnatelné s historicky uváděnými kontrolními skupinami léčenými adjuvantní chemoterapií s doxorubicinem (Lana, 2007). Protože však těchto případů bylo jen několik a jiné studie uváděly lepší výsledky, je nutno k předpokladům o skutečných benefitech pro hodnocenou populaci přistupovat obezřetně.
V Elmsliově studii (2008) byl výrazný, statisticky významný rozdíl v přežití mezi případy léčenými adjuvantní metronomickou terapií a těmi, které jí léčeny nebyly. Uváděné lepší výsledky přežití u pacientů na metronomické chemoterapii však byly srovnatelné s obdobnými případy, které vůbec nebyly léčeny chemoterapií (Chase 2009, Stefanello 2009, McSporran 2009). Ve studii zabývající se metronomickou terapií lomustinem znemožnil nekonzistentní management pacientů vytvoření jakýchkoli závěrů ohledně účinnosti. Cílem studie bylo navíc hodnocení toxicity, nikoli léčebného účinku. Přesto se na základě uváděného delšího přežití některých pacientů účinnost předpokládá (Tripp 2011). Studie používající chlorambucil byly podle mého názoru zajímavé, nedokázaly však přinést dostatečné důkazy účinnosti. Poskytly však zajímavé důkazy o tolerabilitě léčby. Doufejme, že další práce přinesou přesvědčivější důkazy o jejích přínosech (Leach 2012, Schrempp 2013).
Použity byly, mimo jiné:
Ačkoli se obvyklé akutní nežádoucí účinky spojované s konvenční cytotoxickou chemoterapií při použití protokolů metronomické chemoterapie nevyskytují, jistá rizika tu přesto jsou. V až 25 % případů se objeví mírné až středně závažné gastrointestinální obtíže. Léčba založená na cyklofosfamidu stále vytváří riziko sterilní hemoragické cystitidy. Dlouhodobá metronomická chemoterapie lomustinem byla spojována s potenciálně životu nebezpečnou trombocytopenií.
V současnosti se metronomická chemoterapie stále nachází v zóně aktivního výzkumu. Ve veterinární medicíně zatím neexistuje dostatek důkazů pro přímé doporučení léčby. Rovněž je důležité zmínit, že žádná z popsaných léčebných strategií nepoužívala léky schválené pro podávání psům nebo kočkám.
II.INHIBITORY TYROSINKINÁZY
Medicína vždy využívala empirické metody: pomocí základních vědeckých principů observace, racionalizace, hypotézy a jejího zpochybnění byly podávány a zdokonalovány přípravky s léčivými vlastnostmi a současně se rozvíjelo i naše poznání nemocí, které jimi léčíme. Většina léčiv je odvozena od přírodních látek, případně se jedná o syntetické látky vyvinuté tak, aby napodobovaly biochemické účinky dříve používaných přípravků se známými léčivými vlastnostmi.
Bylo již známo, že inhibitory proteinových kináz blokují specifickou kinázu a tedy přenos signálu na další molekulu. K léčbě se mohou využít inhibitory, které blokují prorůstové signály nebo signály bránící apoptóze. Blokáda může být cílena na nádorovou buňku nebo na angiogenezi.
V roce 1991 se začalo pracovat na vytvoření molekuly určené k léčbě chronické myeloidní leukémie (CML) u lidí. Tato molekula však nebyla odvozena od dříve užívaného, méně vhodného přípravku; k její tvorbě byly využity zcela nové metody počítačového vývoje léků. K CML obvykle dochází kvůli chromozomální translokaci, jejímž výsledkem je zmutovaný a tedy permanentně aktivovaný receptor růstového faktoru. Trojrozměrná struktura tohoto zmutovaného receptoru byla přesně popsána a na jejím základě byla vytvořena molekula, která přesně zapadá do aktivního místa zmutovaného proteinu a blokuje jej a přitom je natolik specifická, že minimalizuje necílové interakce a vedlejší účinky (Obrázek č. 1). Tato molekula, STI571, tehdy nazývaná imatinib (Gleevec, Novartis) byla schválena FDA v roce 2001 a revolučně proměnila management svého cílového onemocnění (Druker 2001).
Zmutovaný receptor růstového faktoru je členem „rodiny“ receptorů růstových faktorů označovaných v biochemii jako tyrosinkinázové receptory (název, který odkazuje na způsob jejich aktivace a transdukce signálu). První z téměř 30 inhibitorů tyrosinkinázy (TKI), které jsou nyní schváleny pro medicínské využití, byl Gleevec; pouze jeden z těchto TKI je v CZ a na SK schválen pro použití u psů k léčbě kožní neoplazie žírných buněk a jedná se o účinnou látku masitinib (Masivet®, AB Science).
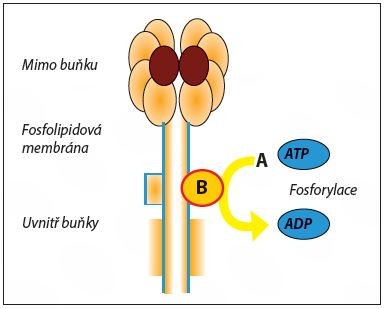
Obrázek č.1
Diagram znázorňující mechanismus působení inhibitorů tyrosinkinázy.
A. Mutace receptorové molekuly vede ke konstitutivní aktivaci dráhy růstu nebo přežití.
B. V přítomnosti selektivní inhibitorové molekuly je konstitutivně aktivovaná molekula inhibována; jaderná transdukce signálů růstu nebo přežití neprobíhá.
Rozšířením modelu CML byla prokázána obdobná mutace u receptoru pro růstový faktor na povrchu buněk (c-kit) u mnoha kožních nádorů žírných buněk u psů (London 1999). Ranné práce naznačovaly, že zmutovaný receptor pro růstový faktor nese 8-12 % všech nádorů ze žírných buněk, později však bylo prokázáno velmi silné spojení mutace c-kit a nádory vyššího stupně diferenciace (Zemke 2002).
Mastinib (Masivet®, AB Science) je vysoce selektivní inhibitor mutovaného receptoru c-kit. Byl prvním TKI uvedeným na veterinární trh. V Evropě byl schválen v červnu 2009 a dosáhl mimořádných výsledků u vybrané populace psích pacientů s kožními nádory ze žírných buněk (Vos, osobní komunikace). Druhým veterinárním TKI, určeným pro léčbu kožních nádorů žírných buněk u psů je toceranib (Palladia®, Zoetis)*, bohužel ale bez registrace v ČR a na SK.
V klinických zkouškách léků Palladia® a Masivet® reagovalo zhruba 65 % mutovaných případů. U zkoušek přípravku Masivet® vykazovalo odpověď 20 % případů bez mutace oproti 39 % ve zkouškách přípravku Palladia®. Příčinu rozdílné míry odpovědi mezi nemutovanými případy lze pravděpodobně vysvětlit širokým spektrem účinků přípravku Palladia®: kromě účinkování proti receptoru c-kit také inhibuje mnoho jiných tyrosinkinázových receptorů včetně receptoru vaskulárního endotelového růstového faktoru (VEGFR), což vede k antiangiogennímu účinku a inhibici růstu prostřednictvím antagonismu receptoru c-kit.
Existují také zprávy o účinnosti těchto léčiv i proti jiným typům nádorů než pouze těm, proti kterým byly vyvinuty. Například u toceranibu je (pravděpodobně díky širšímu spektru cílových molekul) zaznamenána širší škála cílů včetně karcinomu análních žláz, karcinomu štítné žlázy a skvamocelulárního karcinomu hlavy a krku (London 2012).
VEDLEJŠÍ ÚČINKY
Měli bychom zde zmínit, že vzhledem k novému způsobu fungování těchto látek je nezbytné i nové pojetí vedlejších účinků. Jedním z vedlejších účinků používání přípravku Masivet® je například tzv. syndrom ztráty proteinů, zcela nový fenomén, který bude k plnému prozkoumání a správnému uchopení nepochybně vyžadovat dostatek času a koordinovaného výzkumu.
MASIVET®, (AB Science)
Asi 12,5 % případů léčených přípravkem Masivet® jevilo vedlejší účinky 3. nebo 4. stupně, z toho 5 % gastrointestinálních obtíže, 5 % ztrátu proteinů a/nebo ledvinové obtíže a 2,5 % hemolytickou anémii, přičemž 3. stupeň lze zhruba popsat jako závažný; 4. stupeň jako životu nebezpečný. Mechanismem vzniku gastrointestinálních příznaků je interference s receptorem c-kit v pacemakerových buňkách střeva (Cajalovy buňky). Ve značné části případů došlo ke zvracení či průjmu nízkého stupně, 94 % z nich se však zotavilo spontánně bez nutnosti přerušení chemoterapie nebo specifické léčby. U 7,5 % se rozvinul syndrom ztráty proteinů. V současnosti je již zřejmé, že mechanismem syndromu ztráty proteinů je vliv na průměr kapilárních fenestrací, umožňující únik větších molekul včetně albuminu, což vede ke ztrátě albuminu z oběhu do tkáňového moku a do glomerulů. Syndrom ztráty proteinů je zcela reverzibilní. Hemolytická anémie stále není dostatečně popsána. Průměrná délka prodlevy mezi zahájením terapie a zjištěním anémie je 84 dní. V současnosti je nutno v takovém případě doporučit přerušení chemoterapie; v opačném případě může hrozit i smrt pacienta. Rovněž bývá pozorována anémie či chronické zánětlivé onemocnění, ty však nesmíme zaměňovat s životu nebezpečnou hemolytickou anémií.
PALLADIA® (Zoetis)*
Asi 34,5 % případů kožních nádorů ze žírných buněk léčených přípravkem Palladia® jevilo vedlejší účinky 3. nebo 4. stupně; většinou šlo o gastrointestinální příznaky. Zkušenosti s tímto léčivem odhalily rovněž další nežádoucí účinky, které nebyly často hlášeny jako významné nálezy v první klinické zkoušce, mj. spontánní hemoragii, výraznou letargii a gastrointestinální vředy. Častý výskyt závažných vedlejších účinků na trávicí trakt je vysvětlován účinkem toceranibu na cévy vyživující nádor ze žírných buněk. Poškození cévního zásobení vede k nekróze neoplastických žírných buněk a degranulaci. Výsledkem náhlého uvolnění histaminu, eotaxinu a jiných mediátorů zánětu je překyselení žaludku, žaludeční vředy, hypotenze, hypoperfuze ledvin, potenciálně také DIC a smrt. Někteří hlavní názoroví lídři podávají tuto látku pouze v omezeném dávkování a po šesti měsících předchozí léčby vinblastinem a prednisolonem, která má riziko výše popsaných dopadů degranulace odstranit. Zajímavé je, že podle mých zkušeností se vedlejší účinky u psů s neoplaziemi jiného typu než neoplazie žírných buněk zdají být méně závažné.
Zaznamenáme-li toxické účinky, léčba by měla být přerušena. Přesná délka tohoto přerušení závisí na závažnosti projevu toxicity.
*Poznámka redakce: přípravek Palladia® není v ČR ani na SK registrován.
ÚSPĚŠNOST LÉČBY
Ve zveřejněné klinické zkoušce zůstalo pouze něco přes 20 % případů léčených mastinibem naživu a bez progrese onemocnění i v době uzavření studie, tedy dva roky od zahájení léčby. Rovněž došlo k zajímavému pozorování, že v rozporu s poznatky z léčby rakoviny konvenční chemoterapií (v níž se považuje za selhání léčby, pokud nedojde ke zmenšení nádoru) zde bylo konstatováno, že případy, u nichž nedošlo k rozvoji progresivního onemocnění do 12 týdnů od zahájení terapie, zůstaly po delší dobu ve stabilním stavu.
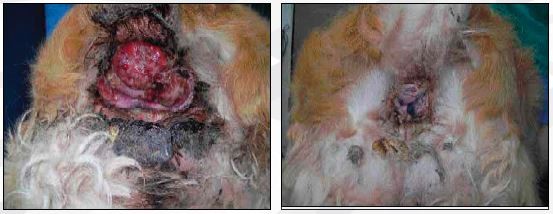
Obrázek č. 2: Úspěšný management vředujícího, vysoce diferencovaného nádoru ze žírných buněk kůže a měkkých tkání v perianální oblasti s využitím inhibitoru tyrosinkinázy. Za pouhých 13 dní byla původní hmota měřící v průměru 79 mm zredukována na tenký proužek granulační tkáně dorsálně od análního tvoru.
Dlouhodobé údaje ohledně reakce nádorů ze žírných buněk na toceranib zatím nejsou k dispozici, je však velmi pravděpodobné, že by se mohlo jednat o podobný typ přetrvávající odpovědi.
VÝBĚR PŘÍPADŮ
Vhodnými kandidáty na TKI terapii jsou pacienti, které nelze léčit chirurgicky, mají vysoký stupeň diferenciace či systémové metastázy. Předtím, než se rozhodneme pro lékovou terapii, která může v nevhodně zvoleném případě selhat, je důležité zvážit, zda by kompletní resekci nádoru, který považujeme za neresekovatelný, nemohl případně provést někdo jiný.
Pacienti se závažnými systémovými chorobami vyžadují velmi pečlivý management. Kontraindikací léčby mastinibem (a je rozumné předpokládat, že i toceranibem) je hepatopatie. Tyto látky jsou metabolizovány systémem jaterních mikrozomálních oxidáz, který má při jaterních onemocněních sníženou kapacitu. Výsledkem je neúmyslné předávkování léčivem s potenciálně katastrofickými následky. U mastinibu i toceranibu byla popsána neutropenie. V obou případech se však tento stav nerozvíjí rychle a po přerušení léčby zcela vymizí.
III.LIPOZOMÁLNÍ NANOČÁSTICE
Cytotoxická chemoterapie je součástí léčby rakoviny již od 50. let minulého století. Již od té doby však výrobce léčiv tíží řada problémů, spojených s dopravením léčivé látky do cílového nádoru. Jedním z těchto problémů je otázka selektivní toxicity. Pokud bychom dokázali dopravit do cílové tkáně vyšší koncentraci aktivní látky, aniž by přitom pronikala do zbytku organismu, dosáhli bychom výrazného rozšíření terapeutického okna s výslednou možností zavést do nádoru mnohem vyšší dávky léčiva. Již mnoho desetiletí proto vědci pracují na vytvoření vhodných přenašečových molekul, které by dokázaly bezpečně a účinně dopravit molekuly léčiva do cílové tkáně. Lipozomy jsou amfipatické molekuly o „nano“ rozměrech, které lze použít k solubilizaci široké škály léčivých látek pro zlepšení jejich farmakologických vlastností.
V roce 2012 byla zveřejněna multicentrická studie zkoumající roli nové formulace cytotoxické látky paclitaxel v lipozomální nanočástici XR-17 (Vail 2012). Paclitaxel je silná cytotoxická látka, široce využívaná v humánní onkologii pro léčbu mnoha typů rakovin. Ve vodném roztoku je nerozpustná, proto byla formulována v solubilizačním činidle Cremophor EL, které u psů vyvolává závažné akutní zánětlivé reakce. V běžné podobě způsobuje paclitaxel významné komplikace, které vyžadují premedikaci antihistaminy pro zamezení potenciálně smrtelným anafylaktickým komplikacím. V jedné studii jevilo 64 % případů akutní zánětlivou toxicitu (Poirier 2004). Paclitaxel tedy v této podobě nelze psům podávat intravenózně. XR-17 je derivát vitamínu A, má nízkou toxicitu a je tělem snadno eliminován. S použitím XR-17 jako pomocné látky lze paclitaxel psům podávat bezpečně, bez akutních zánětlivých vedlejších účinků administrace. Rané klinické zkoušky přitom prokazují účinnost této léčby u řady veterinárních onkologických pacientů (von Euler, osobní komunikace).
Klinické zkoušky odhalily v randomizované zaslepené studii statisticky významné zlepšení výsledků u léčby paclitaxelem rozpuštěným v lipozomálních nanočásticích oproti kontrolní skupině léčené orálně podávaným lomustinem. Ačkoli jde o zajímavý objev pro léčbu nádorů ze žírných buněk u psů, ověření XR-17 jako funkčního přenašeče, umožňujícího bezpečný a účinný přenos léčiv do nádoru bude mít mnohem širší důsledky. Nepochybně poslouží jako model pro další vývoj léčiv. Lipozomy lze modifikovat dalšími zaměřovacími molekulami. Nádory a tkáně nesou řady markerů, které slouží jako „identifikační označení“ a lze je využít k navádění mobilních částic ke konkrétnímu cíli. Tyto „naváděcí signály“ umožní ještě vyšší refinement selektivního zaměřování na cílové tkáně.
Lipozomální sloučeniny dosahující žádaných zaměřovacích schopností a pozměněných charakteristik uvolňování léčiva jen díky své velikosti a stabilitě již byly vytvořeny. Nekonečné možnosti modifikace pro vylepšení či dokonce individualizaci zacílení na nádory činí z medicíny lipozomálních nanočástic oblast pokračujícího aktivního výzkumu a značného optimismu.
ZÁVĚR
Aktuálně tedy stojíme na prahu nové éry medicíny a je jen rozumné předpokládat, že tempo změn se bude v následujících letech stále zrychlovat. Jejich výsledkem je a bude, že také v klinické veterinární praxi poznáváme nové možnosti ve vývoji léčiv, které již nyní přináší skutečné výsledky a zvyšují welfare zvířat.
Reference jsou k dispozici online na adrese www.veterinaryirelandjournal.com