PharmDr. Tereza Bažantová
V posledních letech se objevují v nabídce pro humánní i veterinární medicínu elektrochemicky aktivované dezinfekční roztoky (ECASa) označované názvy superoxidovaná voda, aktivovaná voda, energizovaná voda, anolyt, neutrální anolyt, aqualit, elektrolyticky okyselená voda apod.
Neutrální elektrolyzovaný roztok (NEW) s pH 6,0-7,0 má vlastnosti vysoce účinného dezinfekčního prostředku, zařazeného mezi zdravotnické prostředky třídy IIb v rámci použití v humánní medicíně a mezi schválené veterinární přípravky ve veterinární medicíně.
Použití elektrolýzy pro dezinfekční účely se prvně objevilo před více než 100 lety, ačkoliv až v roce 1970 začaly být fyzikálně-chemické vlastnosti elektrochemicky aktivovaných roztoků (ECAS) zkoumány v Rusku. Termín „elektrochemická aktivace“ byl oficiálně spojen s Vitoldem Bakhirem v roce 1975.
Článek se dále věnuje podrobnějšímu popisu výroby, složení, účinkům a vlastnímu použití těchto roztoků. Dále pak zmiňuje i stabilitu a bezpečnost.
Na závěr je pak uveden seznam literatury, kde se můžete o této zajímavé metodě a jejich produktech dočíst více.
Ve zdravotnictví nacházejí stále širší uplatnění elektrochemicky aktivované dezinfekční roztoky (ECASa). Kyselý ECA roztok (AEW) se používá k vyššímu stupni dezinfekce v myčkách digestivních endoskopů.
Neutrální elektrolyzovaný roztok (NEW) s pH 6,0-7,0 má vlastnosti vysoce účinného dezinfekčního prostředku, zařazeného mezi zdravotnické prostředky třídy IIb v rámci použití v humánní medicíně a mezi schválené veterinární přípravky ve veterinární medicíně. Neutrální superoxidovaný roztok obsahuje oxidační činidla, a to kyselinu chlornou HOCl a chlornanové ionty OCl-, aktivní chlor 50-500 ppm, oxidoredukční potenciál (ORP) roztoku je > 900 mVa redukční faktor 5-7. Roztoky NEW jsou vhodné k použití na pokožku a sliznice.
Použití elektrolýzy pro dezinfekční účely se prvně objevilo před více než 100 lety, ačkoliv až v roce 1970 začaly být fyzikálně-chemické vlastnosti elektrochemicky aktivovaných roztoků (ECAS) zkoumány v Rusku v All-Russian Institute for Medical Engineering. ECAS od té doby nalezly uplatnění v četných biocidních aplikací, např.: k dezinfekci pitné vody, v potravinářském průmyslu a ve zdravotnictví. (1)
V roce 1972, Bakhir oficiálně zavedl proces „Elektrochemické aktivace (ECA) vody“, kde bylo zjištěno, že anolytické a katolytické roztoky vytvořené z vody s nízkým obsahem minerálů, mají fyzikálně-chemické
parametry a reaktivitu zasadně odlišnou od těch, vytvořených klasickou elektrolýzou. Termín elektrochemická aktivace“ byl oficiálně spojen s Vitoldem Bakhirem v roce 1975. (2)
GENEROVÁNÍ ECAS: ELEKTROLYTICKÉ ČLÁNKY A VÝSLEDNÁ STABILITA
ECAS se vyrábí pomocí elektrolýzy roztoků s nízkým obsahem minerálních solí (elektrolytů), v elektrochemickém článku. (1)
Při elektrolytickém procesu jsou elektrody ponořeny ve vodě a probíhá elektrolytický rozklad. Pozitivní ionty jsou přitahovány k negativní elektrodě a přijímají elektrony z katody. Tvoří se neutrální atomy nebo molekuly. (4)
V anodové komoře, nepřetržitý tok roztoku soli (NaCl) reaguje na povrchu anody, vyrábí chlor a kyslík, ale i jiné reaktivní oxidanty, které jsou uvolněny do objemu tekutiny. Tato reakce je závislá na pH, a (v závislosti na Nernstově rovnici) určuje, která volná forma chloru nejvíce převládá v rámci vytvořeného roztoku: Cl2, HClO nebo ClO-.
Přesné fyzikálně-chemické vlastnosti výsledného anolytu (ECASa) jsou závislé na charakteristických vlastnostech elektrochemického článku a jeho provozních parametrech. V katodické komoře je generován vodík, spolu s jinými reaktivními látkami (především antioxidanty), což vede k poklesu redoxního potenciálu a zvýšení pH. Ačkoli tyto katodické roztoky (ECASc) byly použity pro efektivní čištění průmyslových odpadních vod, mají pouze omezenou antimikrobiální aktivitu. (1)
Technologie ECA využívá elektrolyzéry, v nichž je anodová komora oddělena jednosměrnou semipermeabilní membránou od komory katodové. Dodatečné elektrony z katody procházejí rozpouštědlem k anodě. Takto konstruovaný elektrolyzér umožňuje migraci iontů membránou a zajišťuje oddělení iontů chlóru Cl- a sodíku Na+. Tím se zabrání vzniku vysokých koncentrací kyseliny chlorné HClO) a kyseliny chloristé (HClO4).
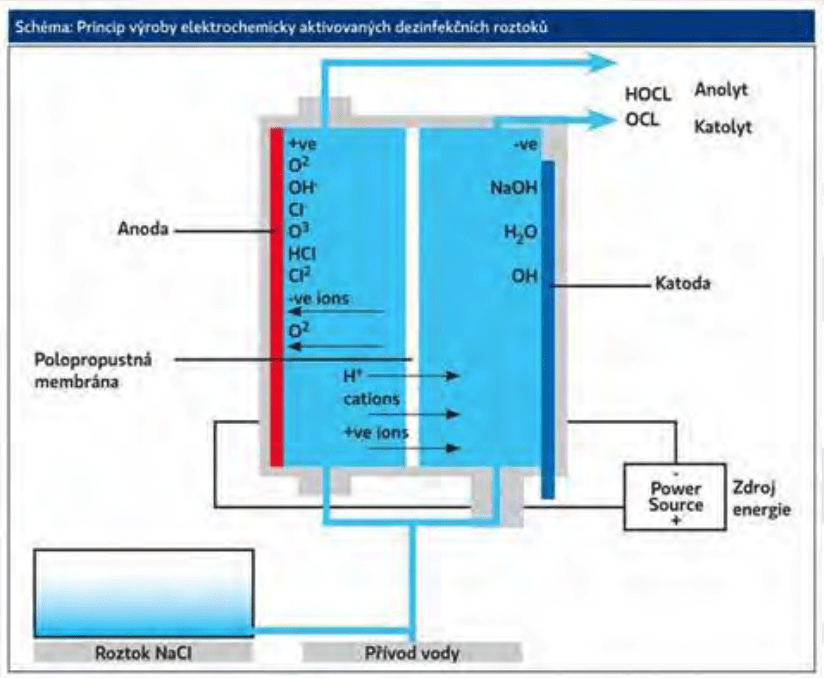
Roztoky NEW s pH 6,0-7,0 se připravují stejně jako AEW, ale část produktu vznikajícího na anodě se přesměruje zpět do katodové komory, čímž se zvýší koncentrace iontů ClO- a upraví pH na požadovanou neutrální hodnotu. Výsledkem je neutrální superoxidovaný roztok, který obsahuje jako oxidační činidla kyselinu chlornou HOCl a chlornanové ionty OCl-, aktivní chlór 50-500 ppm, oxidoredukční potenciál (ORP) roztoku je > 900 mV. (4.)
Zjednodušené, hlavní procesy probíhající v elektrolyzéru lze vyjádřit
následujícím způsobem:
1) oxidace vody na anodě: 2H2O – 4e → 4H+ → + O2;
2) redukce vody na katodě: 2H2O + 2e → H2 + 2OH–;
3) vznik plynného chloru v roztoku chloru na anodě: 2Cl– – 2e → Cl2;
4) vznik vysoce aktivních oxidantů v anodické komoře: Cl2O, ClO2, ClO–, HClO, Cl·, O2·, O3, HO2, OH·;
5) tvorba vysoce aktivních redukčních sloučenin v katodové komoře: OH–, H3–O2–, H2, HO2·, HO2–, O2 (5)
Tabulka 1 Účinnost ECASa proti aerobní, anaerobním a fakultativním bakteriím a eukaryontům
Target organism
Experimental kill rates (k) of various ECASa (log10 CFU ml−1 reduction per minute)
| Aerobic/facultative bacteria | Acidic ECASa | Neutralised ECASa |
| Acinetobacter spp. | + [51] | 10.0 [52] |
| Actinobacillus actinomycetemcomitans | + [53] | + [53] |
| Aeromonas liquefaciens | 13.8 [54] | |
| Alcaligenes faecalis | 13.6 [54] | |
| Bacillus subtilis | + [10] | 1.7 [55] |
| Bacillus cereus | 2.3–5.9 [30, 54, 56] | |
| Burkholderia cepacia | 34.5 [57] | |
| Citrobacter freundii | 13.3 [54] | |
| Campylobacter jejuni | 44.9 [58] | |
| Escherichia coli | 1.4–37.4 [36, 38, 40, 54, 56, 57, 59, 60] | 1.7–16.0 [48, 52, 59, 61] |
| Enterobacter aerogenes | 16.0 [58] | 10.0 [52] |
| Enterococcus spp. | 14.5 [54] | 3.5–15.4 [48, 52, 62] |
| VRE | 3.5–10.0 [52, 62] | |
| Flavobacter spp. | 14.2 [54] | |
| Haemophilus influenzae | >10.0 [52] | |
| Helicobacter pylori | + [63] | 3.50 [62] |
| Lactobacillus spp. | 4.4–5.0 [55] | |
| Legionella pneumophila | 8.0 [64] | |
| Listeria monocytogenes | 1.3–16.3 [36, 40, 56, 65] | |
| Klebsiella spp. | 10.0 [52] | |
| Micrococcus luteus | 10.0 [52] | |
| Mycobacterium spp. | + [66, 67] | 3.5–5.1 [57, 63] |
| Proteus spp. | 14.0 [54] | 10.0 [52] |
| Pseudomonas aeruginosa | 14.1–37.4 [54, 57, 68] | 8.0–16.0 [48, 52, 64] |
| Salmonella spp. | 6.1–8.0 [59, 69] | 5.2–16.0 [59, 61, 65] |
| Serratia marcescens | 37.4 [57] | 10.0 [52] |
| Staphylococcus spp. | 3.7–37.4 [54, 57, 59, 60, 69] | 3.9–16.0 [55, 59, 61, 64, 69] |
| MRSA | 28.8–37.4 [57, 68] | 13.4 [48] |
| MRSE | 3.2 [55] | |
| Streptococcus spp. | + [51, 53] | 3.8–5.0 [55] |
| Xanthomonas maltophilia | + [51] | |
| Anaerobic bacteria | ||
| Actinomyces spp. | + [53] | 2.9 [55] |
| Bifidobacterium bifidum | 5.0 [55] | |
| Bacteroides fragilis | 10.0 [52] | |
| Eubacterium lentum | 3.0 [55] | |
| Fusobacterium nucleatum | + [53] | 2.9 [55] |
| Peptococcus niger | 4.2 [55] | |
| Peptostreptococcus anaerobius | 4.1 [55] | |
| Prevotella melaninogenica | + [53] | 5.8 [55] |
| Porphyromonas spp. | + [53] | 3.5 [55] |
| Prevotella loeschii | + [53] | 5.5 [55] |
| Propionibacterium acnes | 4.6 [55] | |
| Veillonella parvula | 4.7 [55] |
| Bacterial spores | ||
| Bacillus anthracis | 0.2 [70] | |
| Bacillus atrophaeus | 3.7 [68] | 0.4–2.0 [52, 61] |
| Bacillus cereus | 1.32–6.98 [54, 56] | |
| Bacillus subtilis | 0.9 [66] | 1.0–15.0 [48, 71] |
| Clostridium difficile | 16.3 [68] | 2.0 [62] |
| Clostridium perfringens | 0.04 [72] | |
| Streptomyces spp. | + [28] | + [28] |
| Eukaryotes | ||
| Aspergillus spp. | 1.48 [46] | 5.25 [46] |
| Candida spp. | 3.5 [62] | 3.5–16.0 [48, 61, 62, 64] |
| Cryptosporidium parvum oocysts | * [72] | |
| Various environmental fungi | + [70] |
+Qualitative study only
*1.3 log reduction of oocyst infectivity in 1 h
V důsledku elektrochemické aktivace se voda stane metastabilní (aktivovaná) a vykazuje na několik desítek hodin zvýšenou reaktivitu při různých fyzikálních a chemických procesech. Voda aktivovaná katodou (katolyt), zvyšuje aktivitu elektronů a vyznačuje se výrazný- mi redukčními vlastnostmi. Odpovídajícím způsobem, (anolyt) voda aktivovaná anodou se vyznačuje tím, že inhibuje aktivitu elektronů a projevuje vlastnosti jako oxidační činidla. (3)
Transformace elektrolytu do metastabilního stavu není trvalá. Chemické látky přítomné v roztocích se spontánně posunují z tohoto termodynamicky nerovnovážného stavu do stabilní neaktivní formy, během doby známé jako „doba relaxace“. Míra relaxace a poločas aktivního roztoku jsou pro daný roztok specifické. Nicméně, stabilita ECASa může být zlepšena zvýšením hodnoty pH, protože posouvá chemickou rovnováhu k netěkavým druhům chloru, což bylo proká- záno experimentálně. Na rozdíl od významného snížení zbytkového volného chloru, studie ukázaly, že pH, ORP, vodivost a koncentrace chloridových iontů jsou poměrně stabilní v případě krátkodobého skladování, což znamená, že oxidační potenciál těchto roztoků je do značné míry zachován. (1)
IDENTIFIKACE ÚČINNÝCH ANTIMIKROBIÁLNÍCH LÁTEK V ECASa
Hodnoty ORP ECASa se obyčejně pohybují v rozmezí od 800 mV do 1200 mV, čímž je vytvořeno prostředí nevhodné pro řadu důležitých mikrobiálních procesů, včetně mechanismů tvorby energie. Ponořením do těchto roztoků jsou mikroorganismy vystaveny silnému antioxidantu, který s vysokou účinností odlučuje elektrony z mikrobiálních strukturálních sloučenin, čímž dojde k přerušení bio- chemických vazeb a následné ztrátě funkce. Kromě toho se předpokládá, že vysoký ORP prostředí vytvoří nevyváženou osmolaritu mezi koncentrací iontů v roztoku uvnitř jednobuněčného organismu, a tím dojde k poškození membránové struktury. Následkem je zvýšení pórovitosti membrány, která umožní oxidačním zbytkům (přítomných v nadbytku ECASa) proniknout (pomocí difúze) do cytoplazmy buněk, což vede v konečném důsledku k inaktivaci intracelulárních proteinů, lipidů a nukleových kyselin a nefunkčnosti buňky.
Řada experimentálních výzkumů prokázala, že ORP je důležitější hodnotou při hodnocení dezinfekčního potenciálu daného ECASa než obsah volného chloru. ORP je nepřímo úměrný pH. Snížením pH se zvyšuje antimikrobiální potenciál ECASa, i když je koncentrace zbytkové chloru udržována na konstantní úrovni. Ze všech sloučenin chloru je hlavní přítomnou látkou v roztoku při nízkých hodnotách
pH (pH ~ 2 – 5) HOCl. Kromě toho byly v ECASa nalezeny hydroxylové radikály a je pravděpodobné, že kombinace účinných skupin přispívá k antimikrobiální účinnosti ECASa, a to vytvořením antimikrobiální- ho prostředí podobného tomu, přítomnému ve fagozómech ve fagocytárních buňkách imunitního systému savců.
Předpokládá se, že antimikrobiální účinnost ECASa je alespoň částečně závislá na „nespecifických“, nestálých, vysoce reaktivních oxidativních zbytcích. Tyto komponenty reagují s jakýmikoliv organickými sloučeninami přítomnými v životním prostředí, ať už se jedná o požadovaný cíl, nebo ne. Přítomnost organického zatížení v prostředí významně snižuje antimikrobiální potenciál ECASa.
Obecný mechanismus účinku ECASa zahrnuje více cílových míst, což z nich dělá účinné antimikrobiální látky a zároveň se snižuje riziko rozvoje rezistence na tyto látky, v porovnání s používáním antibiotik.
ÚČINNOST ECASa PROTI SPECIFICKÝM MIKROBIÁLNÍM CÍLŮM
BAKTERIE
Tabulka 1 uvádí aerobní, fakultativní a anaerobní druhy bakterií, u kterých byla prokázána citlivost vůči ECASa při in-vitro suspenzních testech. Prezentovány jsou výsledky z anglicky psaných publikací.
Ačkoli předchozí studie prokázaly, že antimikrobiální účinnost je funkcí pH, pH neutrální ECASa mají rovněž široké spektrum baktericidní aktivity. Výhodou neutrálních ECASa je vyšší biokompatibilita a delší doba použitelnosti, při zachování významné antimikrobiální aktivity.
Primárním cílem ECASa je vnější membrána s vysokým obsahem lipidů a bakteriální struktury buněčné membrány. ECASa odlučují z těchto struktur elektrony, způsobují ztrátu jejich stability a umožňují oxidantům proniknout do buněčné cytoplazmy, oxidačně působit a deaktivovat základní buněčné procesy. Nízké pH může také zvýšit vnímavost vnější membrány gramnegativních bakterií buňky, což umožňuje efektivnější vstup kyseliny chlorné do buňky. Předpokládá se, že vysoký ORP ECASa zasahuje do buněčných redoxních signálních drah (např. pár glutathion disulfid – glutathion), což způsobí zvýšenou propustnost buňky, oxidační intra – celulární tvorbu disulfidických můstků a následnou změnou struktury a funkce proteinů lýzu buněk.
BAKTERIÁLNÍ SPÓRY
Spóry bakterií jsou přirozeně odolnější vůči působení antimikrobiálních látek v důsledku různých fyziologických faktorů, a proto i ECASa mají nižší účinnost proti sporám v porovnání s vegetativními buňkami. Významnou sporicidní účinnost in-vitro však prokázaly jak kyselé, tak neutrální ECASa (viz tabulka 1). pH neutrální ECASa mají dokonce vyšší sporocidní aktivitu než některé v současnosti hojně používané biocidy, např. glutaraldehyd, 70 % ethanol, nebo 70% isopropanol. Např.: byla zjištěna významná sporocidní aktivita proti Bacillus anthracis, ekvivalentní 5% chlornanu vápenatého, který je používán Americkou armádou pro dekontaminaci spor na kůži nebo površích předmětů.
Předpokládá se, že ECASa oxidačně modifikují vnitřní membránu, cílové proteiny a nenasycené mastné kyseliny a že tyto membránové struktury se nakonec stanou součástí buněčné membrány rostoucí spory, což v konečném důsledku vede k nefunkčnosti spory.
BIOFILMY
Mikroorganismy jsou známé tím, že vytváří odolnou strukturu biofilmu, považovanou za účinný nástroj pro jejich přežití. In-vitro testy prokázaly účinné odstranění dospělé Pseudomonas aeruginosa ve struktuře biofilmu z povrchu skla a nerezové oceli, po ošetření jak kyselým, tak neutrálním ECASa. Řada dalších studií byla zaměřena na inaktivaci povrchově asociovaných bakteriálních buněk po použití ECASa, a byla prokázána významná účinnost proti Staphylococcus aureus (včetně methicillin-resistentního S. aureus [MRSA]), Entero-coccus faecalis , E. coli, L. monocytogenes, Acinetobacter baumannii, Helicobacter pylori a Mycobacterium spp. Biofilmy vyvolávají obavy zvláště v dutině ústní, neboť polymikrobiální komunity mohou přispět k paradentóze.
Antimikrobiální aktivita ECASa je závislá na vysoce reaktivních nespecifických oxidativních zbytcích, které budou téměř jistě kompetitivně rozloženy díky vysokému organickému zatížení přítomnému ve struktuře biofilmu. Z tohoto důvodu je potřeba používat ECAS v dostatečně vysokých koncentracích a dodržet potřebnou dobu expozice. Jeden z autorů postuloval, že hydroxylové radikály v ECASa mohou způsobit zhroucení vysoce strukturovaného hydratovaného biofilmu matrix odstraněním vodíkových iontů (oxidací) a vystavením buněk z hlubších vrstev biofilmu antimikrobiálním látkám.
EUKARYONTY
ECASa účinně inaktivují některé patogenní eukaryotické druhy (viz tabulka 1) poškozením buněčných funkčních struktur. pH neutrální ECASa prokázaly významnou účinnost proti oocystám C. parvum v kontrastu s malou nebo žádnou aktivitou roztoku obsahujícího volný chlor. Ačkoli citlivost vůči ECASa byla testována pouze u malého počtu eukaryotických patogenů, je zřejmé ze studií s použitím ekologických druhů hub, že ECASa mají významný širokospektrální protiplísňový potenciál.
MIKROBIÁLNÍ TOXINY
Schopnost ECAS inaktivovat bakteriální toxiny byla zkoumána pomocí stafylokokového enterotoxinu A (SEA), odolného vůči vysokým teplotám a rezistentního vůči působení silných kyselin a zásad. Při přebytku ECASa nastala významná inaktivace toxinu. Důkladnou analýzou bylo zjištěno, že imunoreaktivní místo SEA bylo denaturováno (i v přítomnost organického zatížení) a že nadměrnou fragmentací peptidů dochází ke ztrátě aminokyselin. Schopnost ECASa inaktivovat plísňové toxiny byla zkoumána pomocí aflatoxinu Aspergillus parasiticus a významné snížení mutagenního potenciálu tohoto aflatoxinu bylo měřeno pomocí konvenčního Amesova testu. Předpokládá se, že mechanismus účinku je zprostředkovaný působením volných radikálů, protože přítomnost lapačů volných radikálů (mannitol a thiomočovina) výrazně snižuje schopnost ECASa aflatoxin zničit.
VIRY
Mnoho studií prokázalo virucidní aktivitu ECASa proti celé řadě virů, srovnatelnou s jinými biocidními látkami. Nejčastěji se využívá metod, při kterých jsou virové částice v suspenzi vystaveny ECASa v přítomnosti / nepřítomnosti organického zatížení, přičemž ECASa snižují počet živých virových částic (měřeno cytopatickými účinky cílových virionů v následně infikované buněčné linii).
Vzhledem k tomu, že viry nemají buněčné stěny je pravděpodobně mechanismem účinku inaktivace povrchového proteinu, zničení oba- lu viru, inaktivace virových enzymů nebo zničení virové nukleové ky- seliny, společně s eradikací jejich potenciální infekčnosti. Tuto teorii podporuje fakt, že minimálně některé komponenty ECASa pronikají do virového obalu.
POTENCIÁLNÍ TOXICITA
Existuje mnoho vědeckých důkazů dokládajících bezpečnost a netoxičnosti ECASa. Studie akutní toxicity (po jedné dávce) a subakutní toxicity (po 28-ti denní opakované dávce) po orálním podání potkanům neprokázaly žádné důkazy o nežádoucích účincích ECASa. Žádné toxické účinky nebyly prokázány ani u myší s volným přístupem k ECASa ve formě pitné vody po dobu 8 týdnů. Toxicita dále nebyla prokázána např. po aplikaci užitné koncentrace na sliznice při testu akutní orální toxicity (LD50), v testech opakované dráždivosti nebo testech citlivosti.
Zjištěná biokompatibilita byla často stanovena na základě expozice vysokým hladinám ECAS, ve srovnání s předpokládanou nízkou hladinou, která by byla použita v reálné klinické praxi. Inkubace in-vitro lidských buněčných linií s ECASa vykazuje více smíšené výsledky, kdy některé studie neprokázaly žádný účinek, zatímco jiné prokázaly významný cytotoxický účinek, i když obvykle v menší míře než ostatní běžně používané biocidy. Nicméně, in-vitro cytotoxicita ne vždy svědčí o toxicitě při použití in-vivo, jak již bylo pozorováno dříve. In-vitro studie mutagenity neprokázaly žádné důkazy o ECASa indukované genotoxicitě, jak při použití Amesova testu, tak při mikronukleárním testu genotoxicity. Rozsáhlá in-vitro studie toxicity neutrálních ECASa na kožních fibroblastech neprokázala poškození nukleových kyselin ani indukované oxidativní poškození. Tato studie vedla autory k závěru, že účinek ECASa není zaměřen na buněčná jádra, ale vyvolává pouze mírné poškození membrány buněk, nevyvolává oxidaci DNA a neurychluje stárnutí.
POTENCIÁLNÍ KOROZNÍ PŮSOBENÍ ECASa
Nejnovější studie korozního působení ECAS prokázala, že kyselé ECASa nemají nežádoucí účinky na nerezové povrchy (po 8-denním kontaktu), ale významná koroze byla pozorována u uhlíkové oceli a v menší míře na měděných a hliníkových površích, a to z důvodu citlivosti těchto materiálů k oxidačním činidlům (zejména chloridovým iontům). Tato studie poukazuje na to, jak může být korozívní účinek omezen při použití neutrálních ECASa a klade důraz na význam testování korozní povahy specifických ECASa při praktickém používání.
LÉČBA A PREVENCE INFEKCÍ V RÁNĚ
Neutrální ECASa významně zvyšují hojení a snižují bolestivost obtížně léčitelných bércových vředů, jsou využitelné při ošetřování ran v kombinaci s podtlakovou terapií a jsou účinnější než jodpovidon při léčbě vředů diabetické nohy.
Předpokládá se, že přispívají k podpoře hojení snížením bakteriální zátěže poranění, posílením místního krevního toku, urychlením neovaskularizace, potlačením zánětu a tvorbou prostředí nepřátelského k oportunním patogenům. Kromě toho snižují zápach rány reakcí s hnijící nekrotickou tkání.
ECASa byly s úspěchem testovány jako léčebné roztoky při prevenci pooperačních infekcí, a jako roztoky snižující samotnou míru infekce (včetně těch, připadajících na MRSA). ECASa jsou rovněž potenciálně použitelné v dezinfekci povrchu oka a při léčbě zánětlivých aknózních lézí. Mohou být aplikovány různými způsoby (např. postřikem, koupelí, omýváním, atd.) stejně jako v kombinaci s jinými technologiemi, 2-3 krát denně v závislosti na druhu a stupni poranění.
LÉČBA A PREVENCE PARADENTÓZY
Dřívější studie ukázaly, že ECASa jsou schopny odstranit vrstvy stěru z kořenových kanálků in-vivo a být stejně účinné jako chlorhexidin v inhibici tvorby zubního plaku u člověka.(1)
DEZINFEKCE ZDRAVOTNICKÉHO ZAŘÍZENÍ
Jednou z prvních klinických aplikací ECASa byla dezinfekce zdravotnických zařízení. Mnohé studie dokládají jejich účinnost při dezinfekci endoskopů,(6) včetně bronchoskopů a hemodializačních zařízení. Jedním z problémů ve stomatologii je mikrobiální kontaminace vody, která, pokud není dostatečně dezinfikovaná, může obsahovat poly- mikrobiální biofilm s potenciálně patogenními organismy. Vzhledem k tomu, že ECASa jsou prokazatelně účinné při odstraňování biofilmu, jsou užitečné při odstraňování bakterií z těchto lékařských zařízení. Rychlost působení těchto látek snižuje dobu kontaktu a expoziční čas a umožňuje důkladnou dezinfekci lékařského zařízení, což je důležitým faktorem pro opakované použití lékařského zařízení.
DEKONTAMINACE ŽIVOTNÍHO PROSTŘEDÍ
Potenciálně patogenní mikroorganismy mohou přetrvávat ve zdravotnickém zařízení, a to nejen prostřednictvím přímého přenosu z pacienta na pacienta, ale také přežíváním na rozmanitém spektru neživých povrchů. Využití ECASa k dezinfekci neživých povrchů bylo prokázáno experimentálně ve formě mlhoviny proti MRSA, Acinetobacter baumannii a Norovirus. Bylo testováno rovněž použití ECASa jako prostředku k mytí rukou. I když bylo dosaženo významného snížení počtu bakterií v porovnání s mytím ve vodě, ECASa prokázaly pouze omezenou účinnost oproti stávajícím prostředkům. (1)
POUŽITÍ VE VETERINÁRNÍ MEDICÍNĚ
ECASa roztoky lze v rámci veterinární medicíny využít v souladu s výše uvedenými skutečnostmi. Doporučit je lze zejména na poraněnou kůži nebo sliznice za účelem vyčištění rány, snížení rizika infekce, sepse, hniloby a zápachu z rány. Pro ošetření a podporu hojení (léčbu) akutních i chronických ran, odřenin, popálenin a ulcerací ve všech stádiích hojení (očištění, výplach a vlhčení). Ke snížení mikrobiální zátěže – operačních ran, poraněné kůže a sliznice, chronických nehojících se ran, proleženin a povrchu kůže při infekčních a plísňových onemocněních kůže. K výplachům a koupelím genitálu. K ošetření srsti a kůže za účelem odstranění nečistot a zápachu. K ošetření drobných ran, např. po vyjmutí klíštěte. K ošetření meziprstních prostor a záhybů kůže. K ošetření poranění dásní a sliznice ústní dutiny. Roztok se ve všech případech aplikuje neředěný.
LITERATURA
-
M. S. Thorn & S. W. H. Lee & G. M. Robinson & J. Greenman & D. M. Reynolds Electrochemically activated solutions: evidence for antimicrobial efficacy and appli- cations in healthcare environments 2011Eur J Clin Microbiol Infect Dis DOI 10.1007/ s10096-011-1369-9
-
Kirkpatric RD, The mechanism of antimicrobial action of electro-chemically activated (ECA) water and its healthcare applications, 2009 PhD thesis, University of Pretoria, Pretoria, 510 viewed yymmdd < http://upetd.up.ac.za/thesis/available/etd-06112009- 105356/ >
-
The essence of electrochemical activation technology [online], Vitold Bakhir Electrochemical Systems and Technologies [cit. 9.2013] Dostupné z: http://www. bakhir.com/eca/eca-essential.htm
-
Pazdziora E, Elektrochemicky aktivované dezinfekční roztoky, Mladá Fronta Zdravotnické noviny ZDN [online], 11.2010 s. 61 [cit. 30.9.2013] ISSN 1805-2355Dostupné z: http://zdravi.e15.cz/clanek/sestra/ elektrochemicky-aktivovane-dezinfekcni-roztoky-455791
-
Prilutsky VI, Bakhir VM, Electrochemically activated water: anomalous properties, mechanism of biological action: © Moscow (All Russian Scientific Research, and Experimental Institute of Medical Engineering (VNIIIMT), s. 228
-
Selkon JB, Babb JR, Morris R Evaluation of the antimicrobial activity of a new super-oxidized water, Sterilox®,for the disinfection of endoscopes. (1999) J Hosp Infect 41(1):59–70