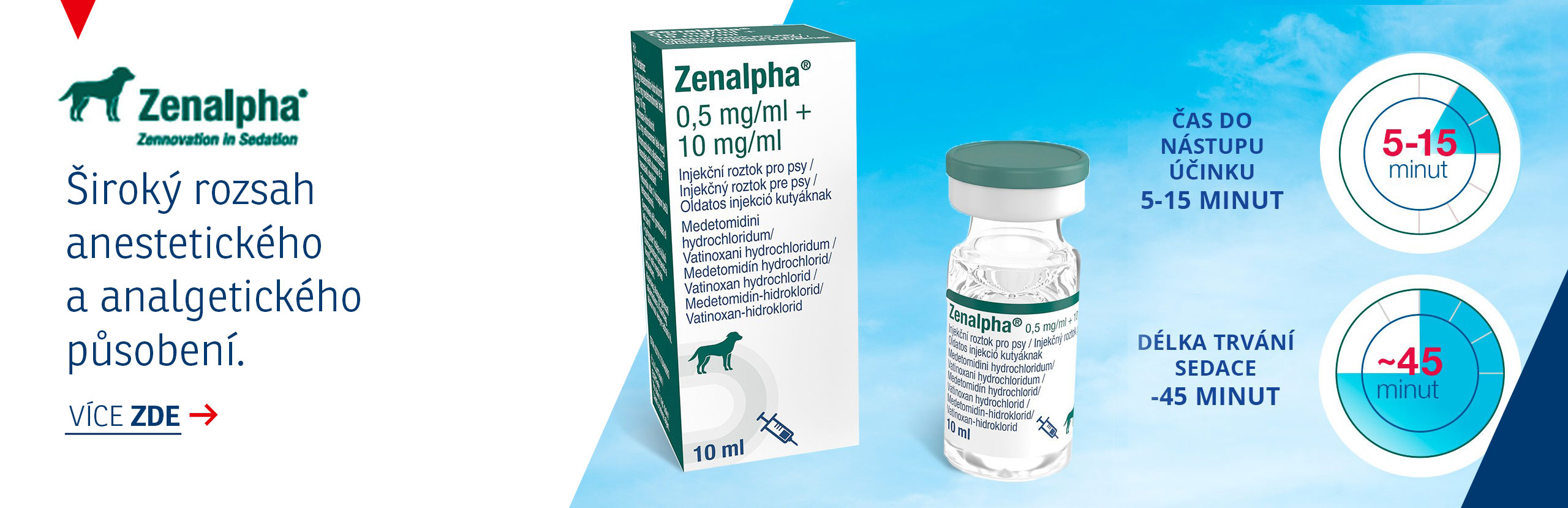
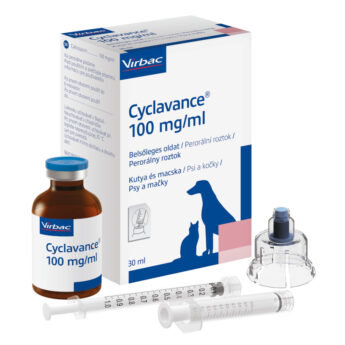
Cyclavance 100 mg/ml perorální roztok pro psy a kočky
Kód:
C00339
Url:
Balení:
30 ml
Léková forma:
roztok
Aktivní látka:
Ciclosporin
Způsob užití:
perorální
Dodavatel:
Virbac SA
Farmakologická skupina:
Onkologické léky
Zvíře:
Kočky, Psi
Informace o produktu: