Flunbix 50 mg/ml, injekční roztok
Kód:
C00598
Url:
.
Balení:
100 ml, 250 ml
Léková forma:
roztok
Aktivní látka:
Flunixini meglumin
Způsob užití:
injekční
Dodavatel:
Biopharm, Výzkumný ústav biofarmacie a veterinárních léčiv, a.s.
Farmakologická skupina:
Muskuloskeletální systém
Zvíře:
Koně, Prasata, Skot
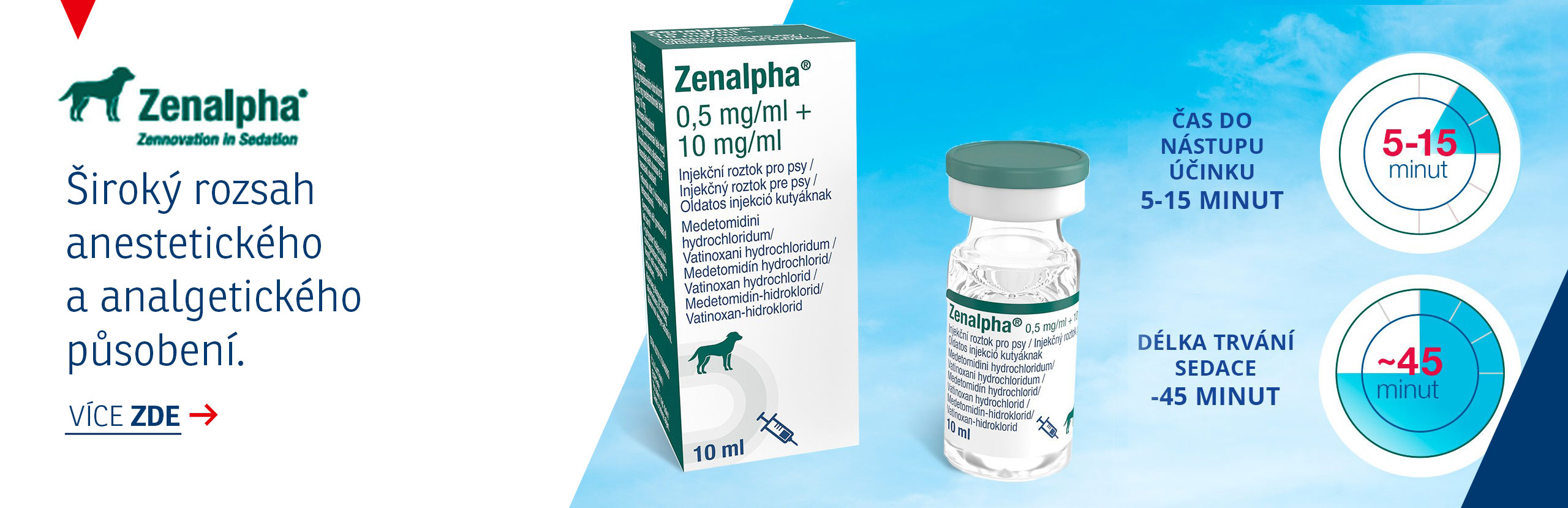
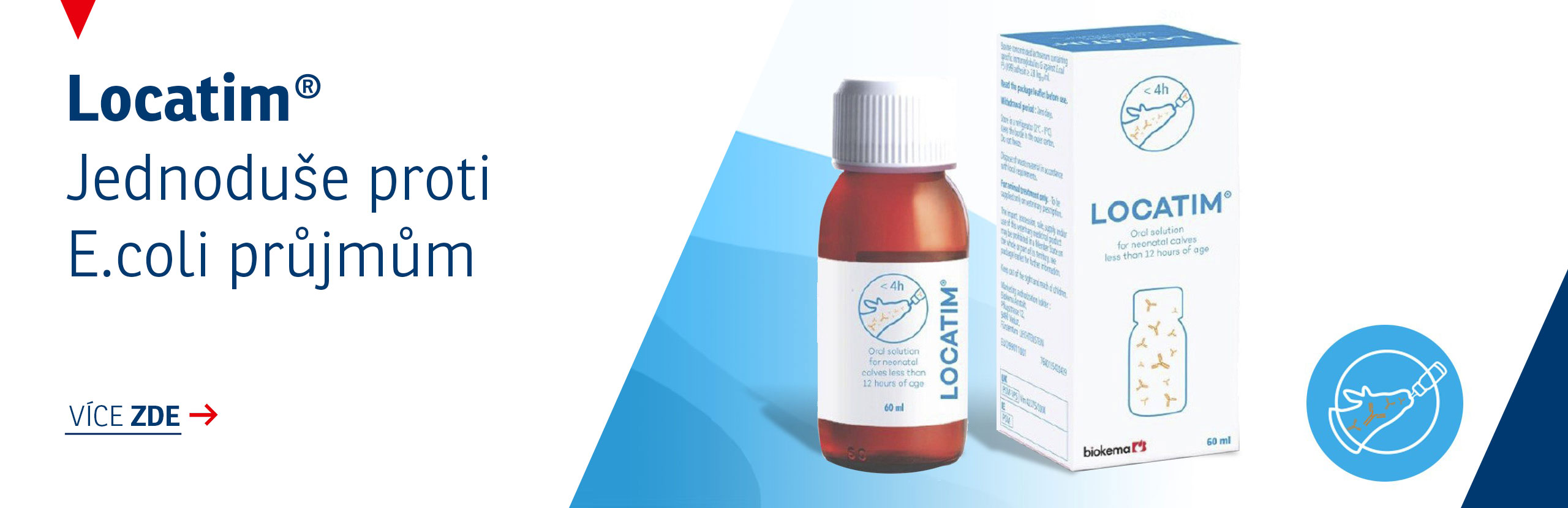
Informace o produktu: