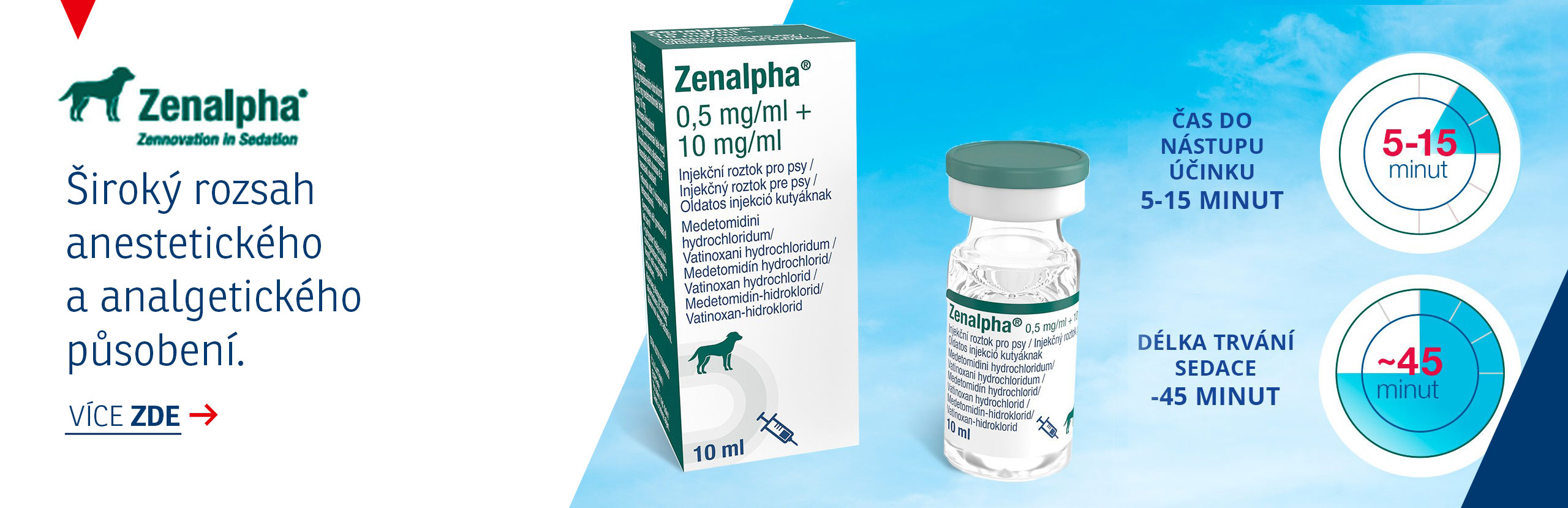
Mastiplan LC, 300 mg/20 mg (Cefapirinum/Prednisolonum), intramamární suspenze pro laktující krávy
Kód:
C01286
Url:
.
Balení:
20 aplikátorů
Léková forma:
suspenze
Aktivní látka:
Cefapirin, Prednisolon
Způsob užití:
intramamární
Dodavatel:
Intervet International , B.V.
Farmakologická skupina:
Antibiotika a ostatní protizánětlivé léky
Zvíře:
Skot
Informace o produktu: