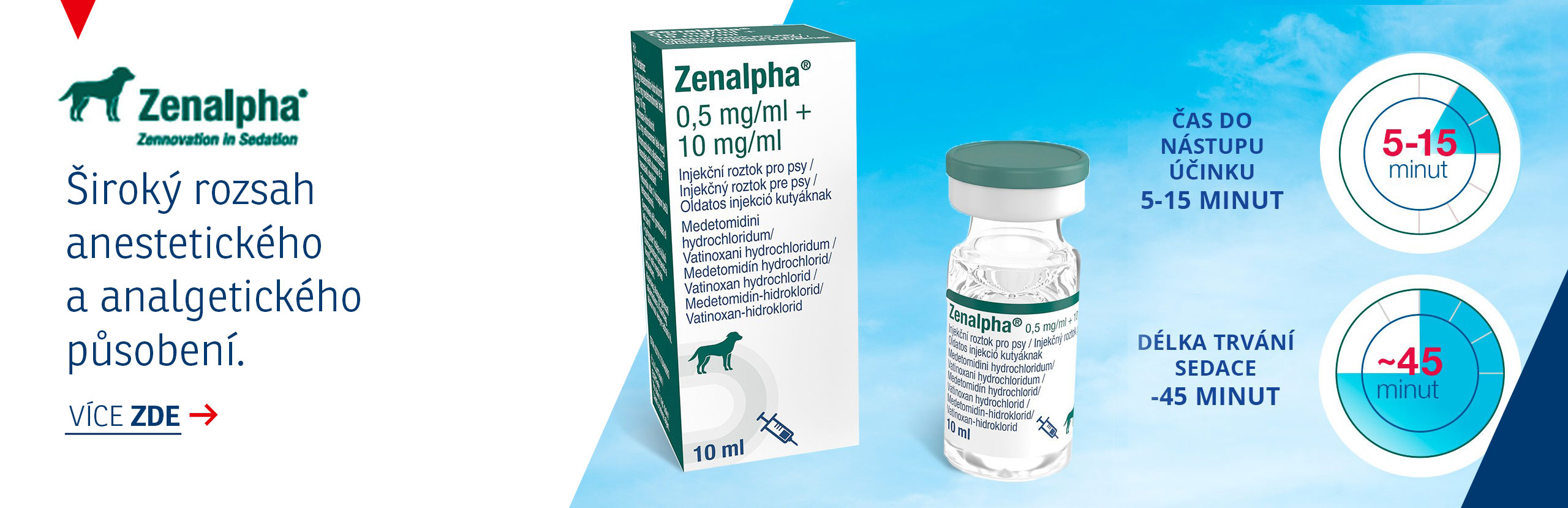
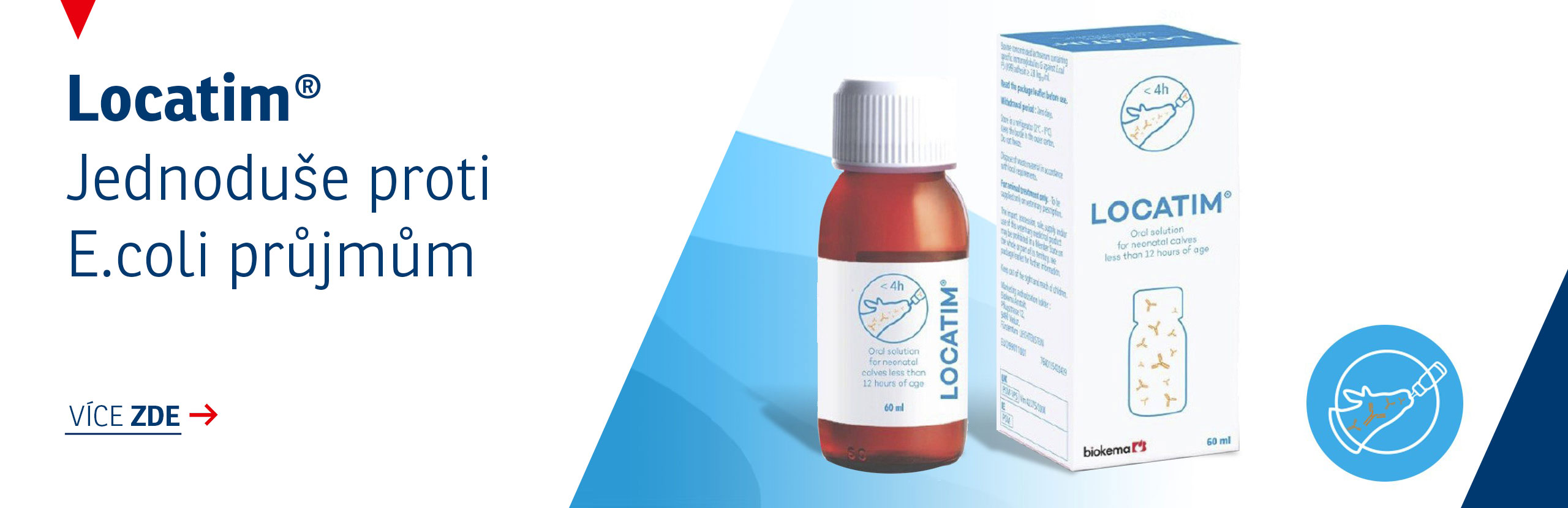
STELFONTA 1 mg/ml injekční roztok pro psy
Kód:
C01801
Url:
Balení:
2 ml
Léková forma:
roztok
Aktivní látka:
Tigilanoli tiglas
Způsob užití:
injekční
Dodavatel:
QBiotics Netherlands B.V.
Farmakologická skupina:
Onkologické léky
Zvíře:
Psi
Informace o produktu: