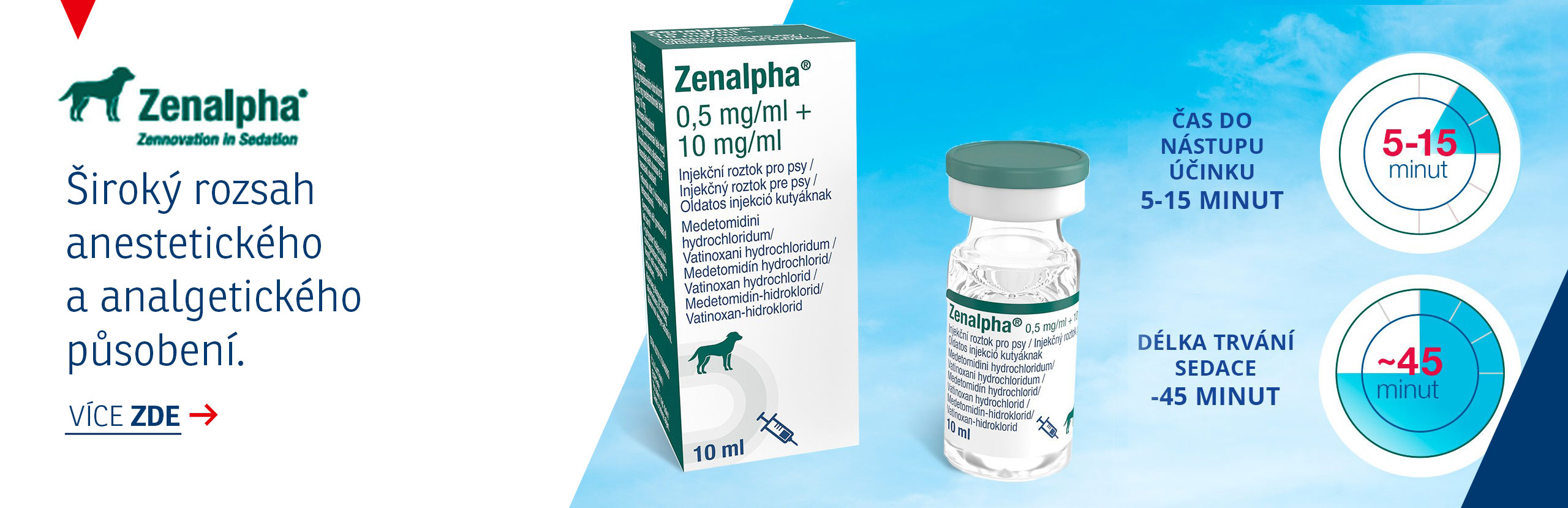
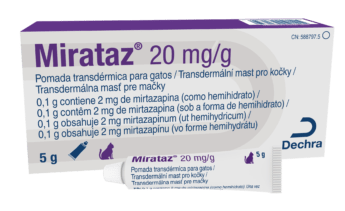
Mirataz 20 mg/g
Kód:
C02247
Url:
Balení:
1 x 5g
Léková forma:
mast
Aktivní látka:
mirtazapin
Způsob užití:
kožní
Dodavatel:
Dechra Regulatory B.V.
Farmakologická skupina:
Nervový systém
Zvíře:
Kočky
Informace o produktu: