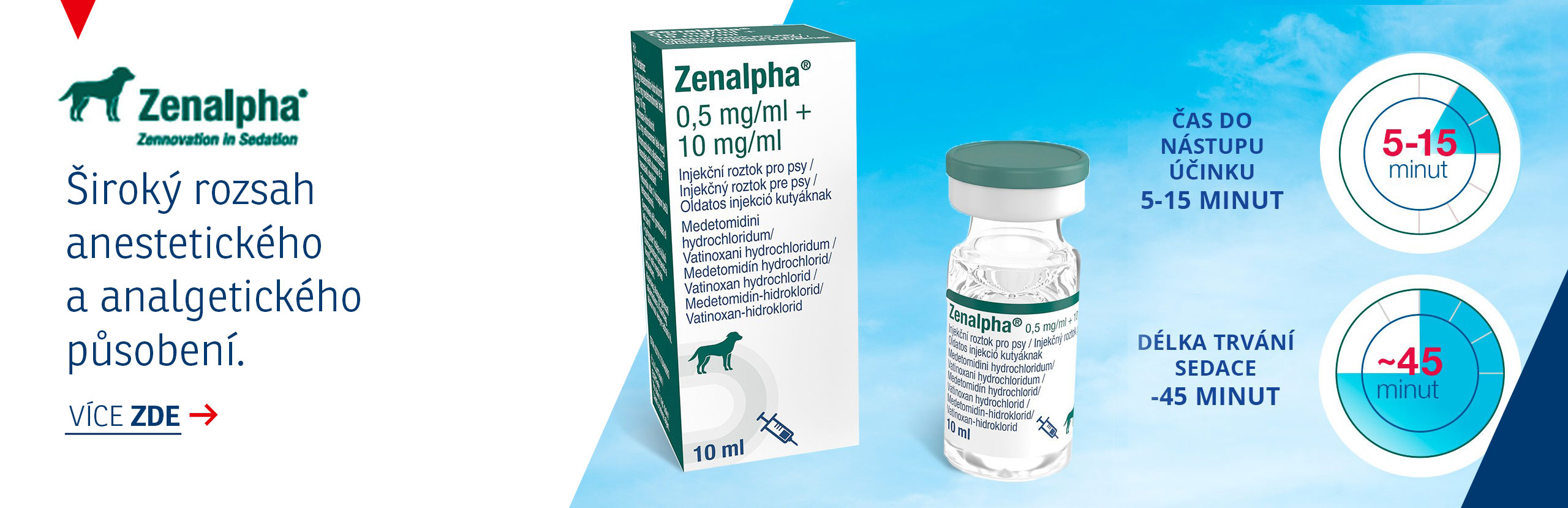
Rilexine 600mg
Kód:
C01612
Url:
Balení:
2 x 7 tablet
Léková forma:
tableta
Aktivní látka:
Cefalexin
Způsob užití:
perorální
Dodavatel:
Virbac SA
Farmakologická skupina:
Antibiotika a ostatní protizánětlivé léky
Zvíře:
Psi
Informace o produktu: