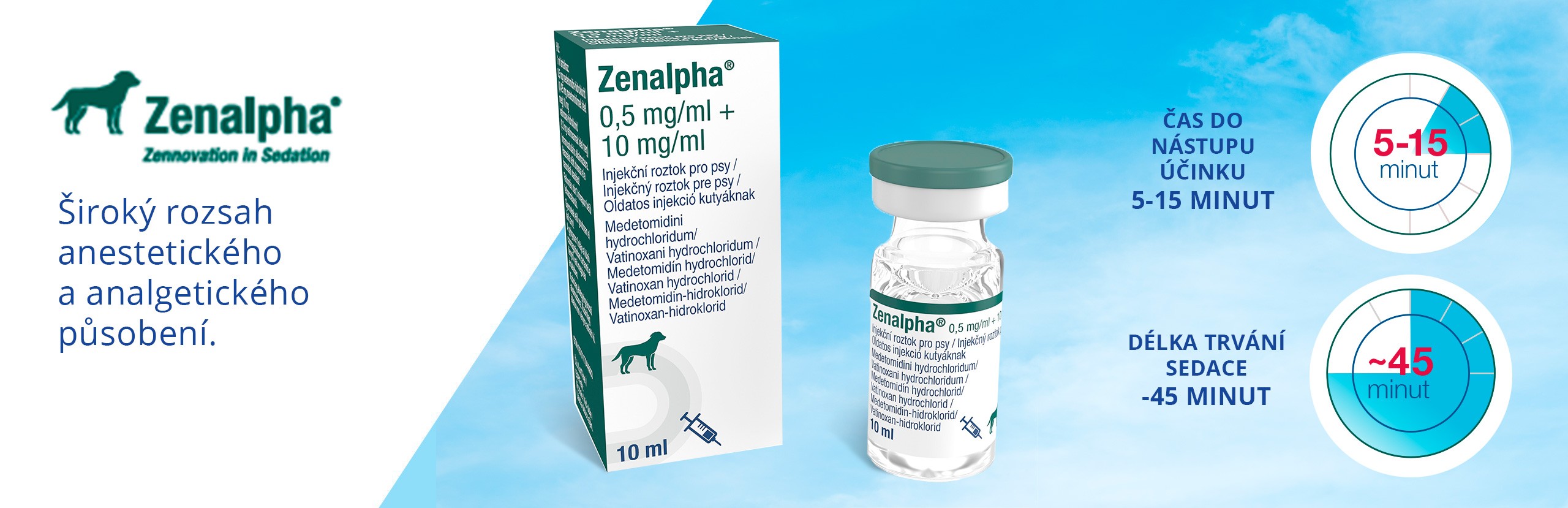
LIDOBEL 20 MG/ML
Kód:
C02240
Url:
Balení:
100 ml
Léková forma:
roztok
Aktivní látka:
Lidocain
Způsob užití:
injekční
Dodavatel:
Bela-Pharm GmbH
Farmakologická skupina:
Anestetika
Zvíře:
Kočky, Koně, Psi
Informace o produktu: