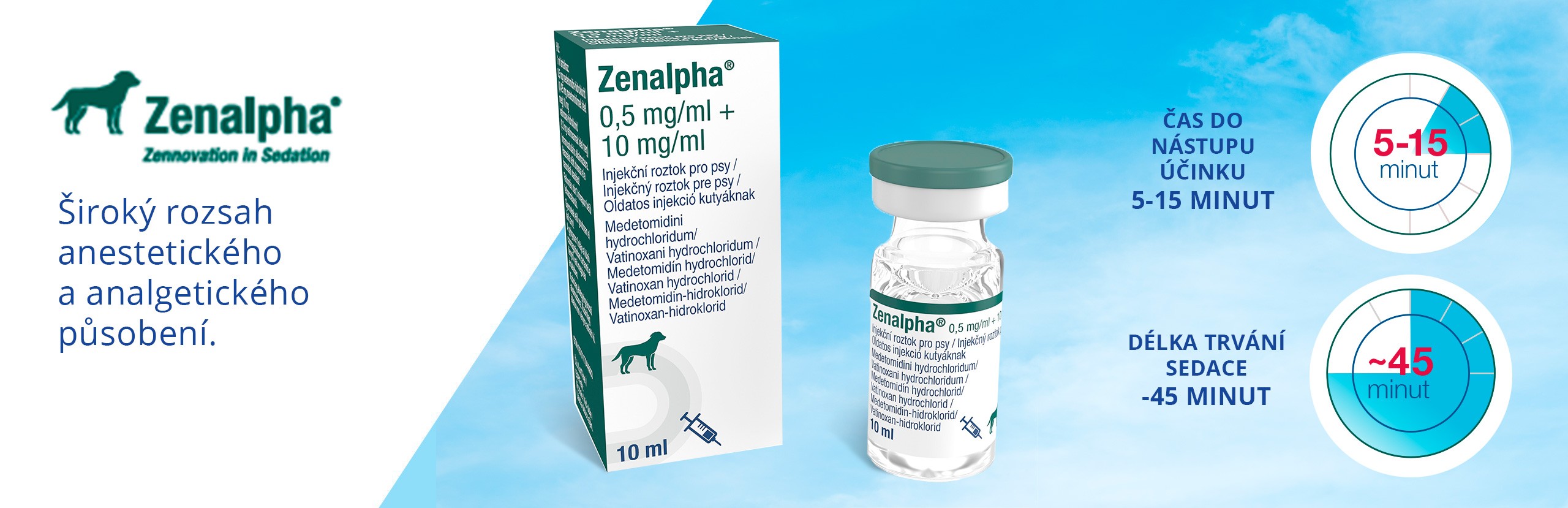
SOLENSIA 7 mg/ml injekční roztok pro kočky
Kód:
C02401
Url:
Balení:
2 x 1 ml
Léková forma:
roztok
Aktivní látka:
Frunevetmab
Způsob užití:
injekční
Dodavatel:
Zoetis Belgium SA
Farmakologická skupina:
Muskuloskeletální systém
Zvíře:
Kočky
Informace o produktu: